¡Hola a todos!
Hace unos días, cuando os hablaba de la estructura atómica, os dije que un átomo se definía como la unidad más pequeña que constituye la materia. Pero... ¿sabéis qué es exactamente la materia?
Bueno... lo cierto es que todo lo que nos rodea es materia, incluso nosotros mismos, pues tenemos una composición química definida; estamos hechos de materia.
La materia es el resultado de la distribución, de una forma u otra, de un conjunto de átomos (los cuales poseen masa) que ocupan un lugar en el espacio y cuyas propiedades se perciben por los sentidos. Por lo tanto, consideramos como materia a todo aquello que tenga masa y volumen. Surge entonces el concepto de densidad (d), que es la cantidad de masa (m) que hay por unidad de volumen (V).
Desde estos enlaces puedes acceder a experimentos interactivos sobre el cálculo de la densidad, el volumen y la masa de un sólido, así como medir la masa de un líquido.
La materia se presenta en la naturaleza en tres estados diferentes, a los que llamamos estados de agregación, cada uno de los cuales se caracteriza por poseer propiedades físicas únicas que los distinguen del resto de estados.
Estos estados de agregación son: sólido, líquido y gaseoso.
En el estado sólido (a), las partículas se encuentran muy fuertemente unidas unas con otras y prácticamente no se mueven, están en posiciones fijas, adaptando una forma definida y concreta. Además, los sólidos muestran gran resistencia a cambiar su forma y ocupan un volumen constante.
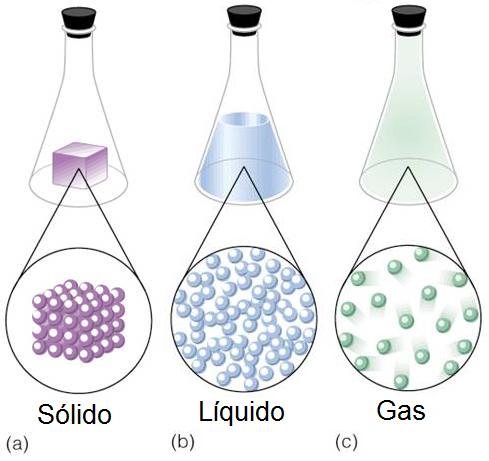 |
| "Estados de agregación de la materia" by Carlos Alonso - CC BY |
En el estado gaseoso (c), las partículas apenas se mueven con casi total libertad, pues no existen una fuerza que las mantenga unidas. Al igual que los líquidos, los gases no poseen una forma fija, sino que adoptan la forma del recipiente que los contiene, mientras que el volumen que ocupan varía también en función del recipiente.
Por tanto, la materia se presentará en un estado u otro dependiendo del tipo de fuerzas que predominen sobre las partículas. Si predominan las fuerzas de cohesión, las partículas estarán muy juntas unas con otras y apenas podrán moverse: estado sólido (a). Si las fuerzas que predominan son de repulsión, las partículas podrán moverse con total libertad y estarán muy alejadas unas de otras: estado gaseoso (c). Si por lo contrario, las fuerzas de cohesión y de repulsión son del mismo orden, las partículas podrán desplazarse con cierta libertad pero sin alejarse unas de otras: estado líquido (b).
Por último, si todavía no lo tienes del todo claro, puedes echarle un vistazo al siguiente vídeo, que te será muy útil para desarrollar la actividad de aprendizaje propuesta.
Por último, si todavía no lo tienes del todo claro, puedes echarle un vistazo al siguiente vídeo, que te será muy útil para desarrollar la actividad de aprendizaje propuesta.